Nutrigenetik auf einen Blick
- Jeder Mensch verarbeitet Nährstoffe unterschiedlich – genetische Varianten sind dafür oft mitverantwortlich.
- Die Nutrigenetik untersucht, wie unsere Gene beeinflussen, wie wir Vitamine, Mineralstoffe und andere Nährstoffe aufnehmen, verwerten und speichern.
- Eine genetische Analyse bietet fundierte Erkenntnisse für eine präzisere Ernährung – individuell, vorbeugend und nachhaltig wirksam.
- Typische Genvarianten beeinflussen unter anderem die Verwertung von Vitamin D, Folsäure, Omega-3-Fettsäuren und Koffein.
- Für manche Menschen ist eine gezielte Zufuhr von Nahrungsergänzungsmitteln notwendig – nicht wegen schlechter Ernährung, sondern wegen genetischer Besonderheiten.
Warum “one size fits all” in der Ernährung nicht funktioniert
Was macht die optimale Ernährung aus? Viele Ernährungsempfehlungen basieren auf Durchschnittswerten – sei es bei Makronährstoffen oder der empfohlenen Tagesdosis für Vitamine und Mineralstoffe. Doch wer in der Praxis berät, weiß: Zwei Menschen können sich identisch ernähren – und erzielen völlig unterschiedliche Ergebnisse.
Ein Beispiel:
Während die eine Person auf eine klassische Diät mit Gewichtsverlust reagiert, bleibt bei der anderen das Gewicht konstant – oder es treten sogar Verdauungsprobleme auf. Die Ursache? Oft liegt sie in der genetischen Ausstattung. Diese individuellen Unterschiede sind mit klassischen Ernährungskonzepten nicht erfassbar. Umso wichtiger sind personalisierte Strategien auf Basis der Gene.
Nutrigenetik als Schlüssel zur personalisierten Gesundheitsstrategie
Die Nutrigenetik liefert uns die Grundlage für ein neues Ernährungsverständnis: nicht allgemeingültig, sondern personalisiert, proaktiv und präzise. Sie ermöglicht es, Ernährungsempfehlungen nicht nur an Lebensstil und Blutwerten, sondern auch an genetischen Faktoren auszurichten – etwa bei der Auswahl und Dosierung von Mikronährstoffen, der Makronährstoffverteilung oder dem Umgang mit Unverträglichkeiten.
Das Ergebnis: ein personalisiertes Ernährungskonzept, das gezielt auf individuelle Bedürfnisse eingehen kann. Gerade im beratenden Umfeld – ob Gesundheitscoaching, Ernährungsberatung, Personal Training oder Heilpraxis – entsteht so ein neuer Qualitätsstandard: wissenschaftlich fundiert, nachvollziehbar und hochrelevant für nachhaltige Ergebnisse.
Nutrigenetik vs. Nutrigenomik – was ist der Unterschied?
Die Begriffe Nutrigenetik und Nutrigenomik werden im Alltag häufig synonym verwendet, doch sie beschreiben zwei unterschiedliche Perspektiven:
- Die Nutrigenetik untersucht, wie unsere genetische Ausstattung beeinflusst, wie wir bestimmte Nährstoffe aufnehmen, verwerten und speichern. Kurz gesagt: Wie reagiert der Körper auf Nährstoffe – abhängig vom individuellen genetischen Profil?
- Die Nutrigenomik geht den umgekehrten Weg: Sie analysiert, wie Nährstoffe die Aktivität unserer Gene verändern können – etwa durch die Aktivierung oder Hemmung bestimmter Signalwege.
Beide Teilbereiche ergänzen sich: Während die Nutrigenetik hilft, individuelle Ernährungsempfehlungen zu formulieren, bietet die Nutrigenomik Ansätze, um mit gezielter Ernährung auf zellulärer Ebene gesundheitsfördernde Effekte zu erzielen.1
Wie genetische Unterschiede Nährstoffaufnahme und -verwertung beeinflussen
Jeder Mensch trägt in seinem Genom kleine, aber bedeutsame Unterschiede – sogenannte SNPs (Single Nucleotide Polymorphisms). Diese genetischen Varianten können beeinflussen, wie effizient bestimmte Enzyme arbeiten, wie aktiv Transportproteine sind oder wie sensibel Rezeptoren auf bestimmte Nährstoffe reagieren.
Diese SNPs sind vererbbar. Das bedeutet, wir bekommen sie von unseren Eltern mitgegeben – wie Augenfarbe, Körpergröße oder Haarstruktur. Manche SNPs sind selten, andere treten hingegen besonders häufig in bestimmten Bevölkerungsgruppen auf. Doch selbst geringfügige Gendefekte können entscheiden, ob wir einen Nährstoff optimal aufnehmen, speichern oder schnell wieder ausscheiden.
So kommt es, dass zwei Menschen auf dieselbe Nährstoffzufuhr völlig unterschiedlich reagieren. In der Praxis ist es daher entscheidend zu wissen, wie ein Körper genetisch eingestellt ist – nicht nur, ob er einen Nährstoff benötigt, sondern ob und wie er ihn nutzen kann. Dieses Wissen liefert einen echten Mehrwert: für präzisere Empfehlungen, für mehr Klarheit im Beratungsprozess – und vor allem für individuell wirksame Lösungen.
Eine Auswahl relevanter Gene im Alltag
Einige Gene und deren Varianten sind besonders gründlich erforscht – und sie tauchen immer wieder in der Beratungspraxis auf, wenn Kunden z.B. berichten: „Ich ernähre mich gesund, aber irgendetwas passt nicht.“ Hier ein paar typische Beispiele, die erklären, warum eine standardisierte Ernährung nicht für alle funktioniert.
LCT-Gen – Was ist mit Laktoseintoleranz?
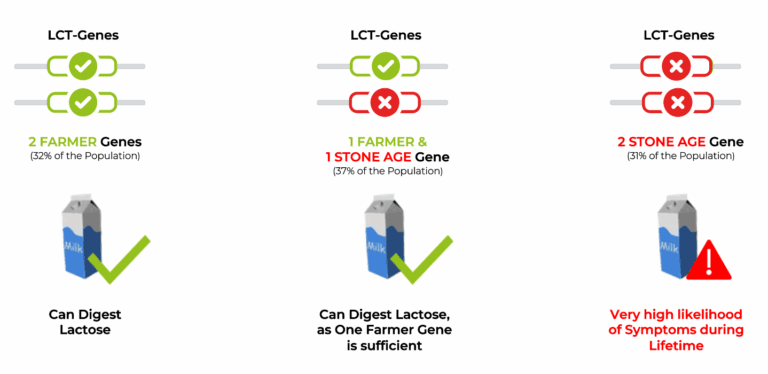
Die Fähigkeit, Laktose – den Milchzucker – zu verdauen, ist genetisch verankert. Verantwortlich dafür ist das LCT-Gen, das die Produktion des Enzyms Laktase steuert. Dieses Enzym spaltet Laktose im Dünndarm und ermöglicht so ihre Aufnahme. Bei den meisten Menschen weltweit wird das LCT-Gen nach dem Säuglingsalter inaktiviert – ein natürlicher Vorgang, der zur sogenannten primären Laktoseintoleranz führt.
Entscheidend ist hierbei die individuelle genetische Konstellation:
- A/A (Wildtyp): hohe Laktaseaktivität – Laktose wird problemlos vertragen.
- A/G (heterozygot): mittlere Aktivität – häufig ausreichend für moderate Mengen Milchprodukte.
- G/G (homozygot): geringe bis keine Aktivität – typische Ausprägung der Laktoseintoleranz mit Symptomen wie Blähungen, Durchfall oder Bauchkrämpfen.
Evolutionärer Hintergrund der Laktasepersistenz
Die Fähigkeit, Milch auch im Erwachsenenalter zu verdauen – die sogenannte Laktasepersistenz – ist ein Paradebeispiel für menschliche Co-Evolution zwischen Genetik und Kultur. Ursprünglich wurde das Enzym Laktase, das für die Spaltung von Milchzucker (Laktose) notwendig ist, nur in der frühen Kindheit produziert. Mit dem Ende der Stillzeit wurde das entsprechende Gen inaktiviert – ein Mechanismus, der dem natürlichen Stoffwechseltyp des Menschen entsprach. Diese ursprüngliche genetische Ausstattung wird heute als „Steinzeit-Gen“ bezeichnet.
Vor etwa 6000 bis 8000 Jahren jedoch trat in bestimmten Populationen eine Mutation im LCT-Gen auf, die es ermöglichte, Laktase auch im Erwachsenenalter weiter zu produzieren. Dieses „Bauern-Gen“ stellte einen klaren Selektionsvorteil dar – vor allem in Gesellschaften, die auf Viehzucht und Milchkonsum angewiesen waren. Milch wurde zur konstanten Nährstoffquelle, reich an Energie, Kalzium und Eiweiß.
Genetische Vielfalt
Diese Verteilung macht deutlich: Laktoseverträglichkeit ist nicht die Norm, sondern eine genetisch bedingte Ausnahme. Die ursprüngliche menschliche Genetik – das Steinzeit-Erbe – sieht keine Milch im Erwachsenenalter vor.
Die Anteile der Bauern- und Steinzeit-Gene in der Bevölkerung.
MTHFR-Gen – Der Schlüssel zur aktiven Folsäure
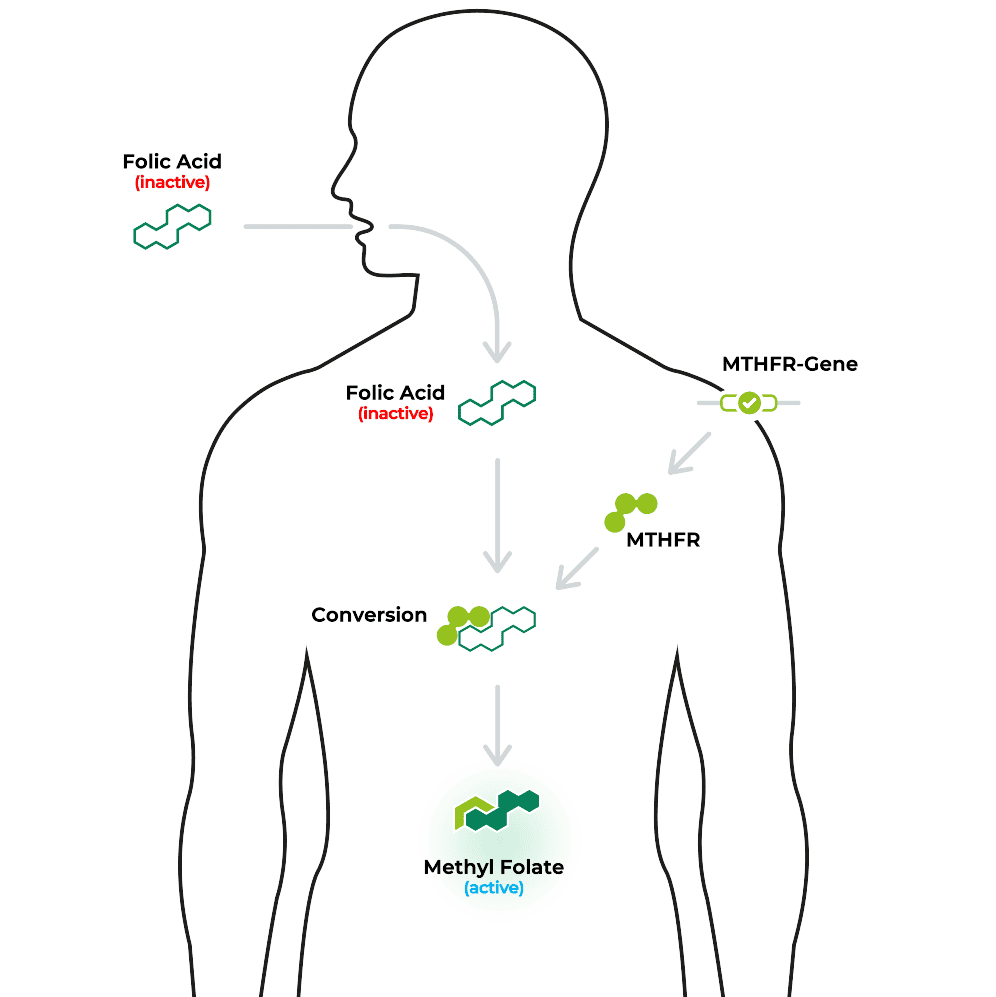
Stellen Sie sich eine Frau vor, die schwanger werden möchte, ihre Ernährung sorgfältig plant und Folsäure supplementiert – und trotzdem zeigt der Homocysteinwert Auffälligkeiten. Der Grund könnte in einer Variante des MTHFR-Gens (z. B. C677T) liegen. Diese verändert die Fähigkeit des Körpers, Folsäure in die biologisch aktive Form Methylfolat umzuwandeln. Trotz Supplementierung kann es zu einer verminderten Verfügbarkeit von aktivem Folat kommen. Das kann Prozesse wie Zellteilung oder Homocystein-Stoffwechsel beeinflussen. Eine genetische Analyse bringt hier oft Licht ins Dunkel.2
Falls die Umwandlung aufgrund der Genvariante eingeschränkt ist, können die Betroffenen auch gleich Methylfolat als Nahrungsergänzung einnehmen.
Mithilfe des MTHFR-Gens wird Folsäure in die biologisch aktive Form Methylfolat umgewandelt.
Coenzym Q10 und das NQO1-Gen – Zellschutz und Genetik im Zusammenspiel
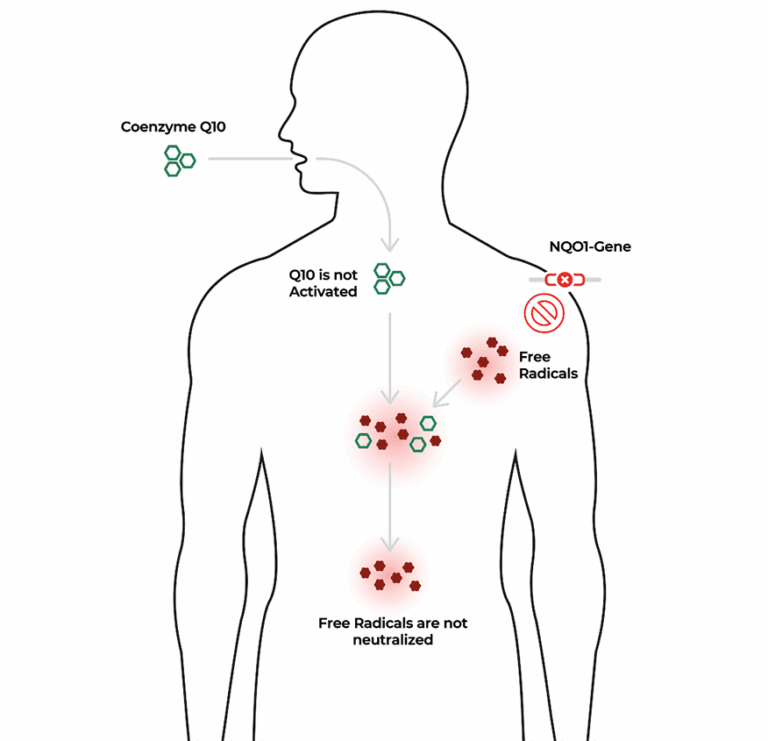
Das NQO1-Gen spielt eine zentrale Rolle im zellulären Schutzsystem gegen oxidative Schäden. Es kodiert für ein Enzym, das unter anderem dafür verantwortlich ist, wichtige Antioxidantien wie Coenzym Q10 (Ubichinon) in ihre biologisch aktive Form Ubiquinol umzuwandeln. Nur in reduzierter Form kann Q10 seine antioxidative Schutzfunktion entfalten und freie Radikale neutralisieren, bevor sie Zellen und Gewebe schädigen.
Bei Menschen mit bestimmten genetischen Varianten ist die Aktivität des NQO1-Enzyms deutlich vermindert oder fällt ganz aus. Die Folge: Die körpereigene Fähigkeit, Ubichinon in Ubiquinol zu aktivieren, ist eingeschränkt. Dadurch kann die Wirkung von oral zugeführtem Q10 in herkömmlicher Form deutlich reduziert sein.3
Bei bestimmten genetischen Varianten im NQO1-Gen ist die Enzymaktivität stark reduziert oder vollständig inaktiv. Dadurch ist der Körper nur eingeschränkt in der Lage, Ubichinon in seine aktive Form Ubiquinol umzuwandeln.
In solchen Fällen ist die gezielte Supplementierung mit Ubiquinol, also der direkt bioverfügbaren und aktiven Form von Q10, besonders empfehlenswert. Die Erkenntnisse der Nutrigenetik bieten hier eine wertvolle Entscheidungsgrundlage, um die antioxidative Abwehr gezielt zu unterstützen und die individuelle Nährstoffstrategie entsprechend anzupassen.
FADS1/FADS2-Gene – Omega-3 wirkt nicht bei allen gleich
Viele Menschen versuchen, über Leinöl oder Walnüsse ihre Omega-3-Zufuhr zu verbessern – ein guter Ansatz. Doch wenn der Körper diese pflanzliche Form (ALA) nicht effizient in die wirksamen Fettsäuren EPA und DHA umwandeln kann, verpufft der Effekt. Träger bestimmter Varianten in den FADS1- und FADS2-Genen haben genau dieses Problem. In solchen Fällen kann oft die direkte Zufuhr über Nahrungsergänzungsmittel wie Fischöl oder vegane Alternativen wie Algenöl sinnvoll sein.
PPARG-Gene – Warum manche schneller zunehmen
In einer klinischen Studie mit 720 Teilnehmern wurde untersucht, wie sich unterschiedliche Ernährungsformen – fettarm vs. fettreich – auf das Gewicht und den Stoffwechsel auswirken. Das überraschende Ergebnis: Die Wirkung der Fettkalorien war alles andere als einheitlich. Während ein Teil der Teilnehmer mit fettreicher Kost problemlos abnehmen konnte oder Gewicht hielt, legte eine andere Gruppe unter exakt denselben Bedingungen deutlich an Körperfett zu. Die Wissenschaftler gingen der Frage nach, warum das so ist – und fanden die Antwort im Erbgut: Besonders das PPARG-Gene zeigte sich als Schlüssel.
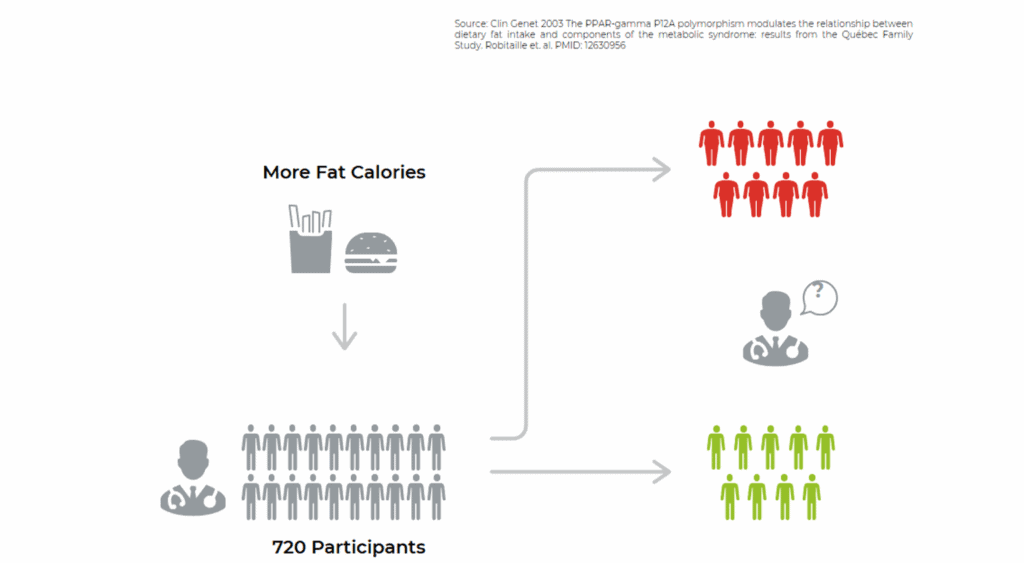
Teilnehmer mit einer bestimmten Variante dieses Gens nahmen Fett aus der Nahrung besonders effizient auf – eine Fähigkeit, die in Zeiten von Nahrungsmangel einst überlebenswichtig war. Heute aber, in einer Umgebung mit ständiger Kalorienverfügbarkeit, kann genau das zu einem Nachteil werden: Fett wird schneller gespeichert, der BMI steigt, das Risiko für Übergewicht und Stoffwechselstörungen nimmt zu.
Die Studie macht eindrucksvoll deutlich: Nicht die Menge allein entscheidet – sondern die genetische Reaktion auf Nährstoffe. Es gibt noch weitere Fettempfindlichkeits-Gene: das FABP2, APOA2, APOAS und FTO. Nutrigenetik hilft, individuelle Empfehlungen zu geben, die das beachten.
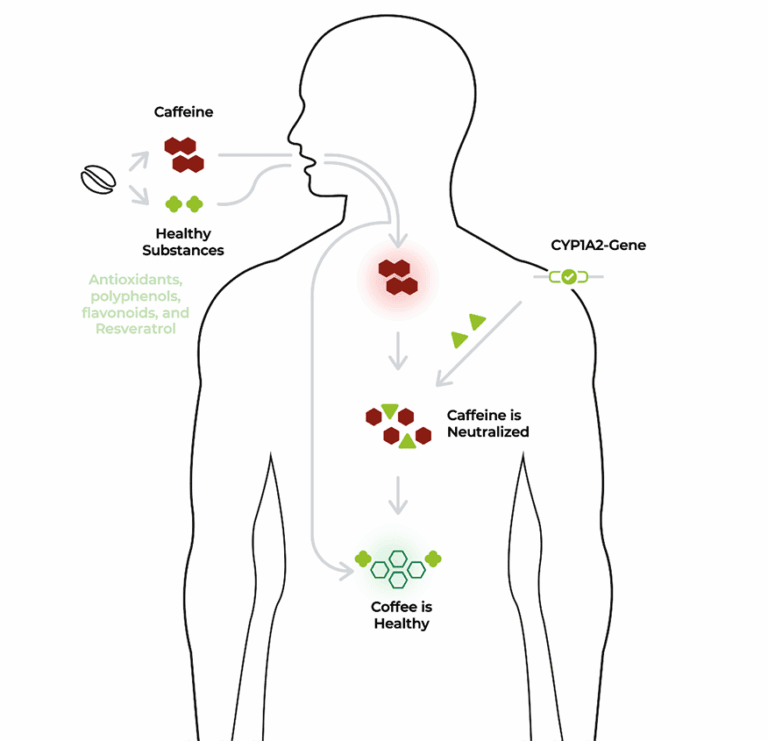
CYP1A2-Gen – Der Koffein-Code
Und dann gibt es den Fall, dass jemand schon nach einer Tasse Kaffee Herzklopfen bekommt – während andere am Abend noch Espresso trinken können und schlafen wie ein Stein. Das CYP1A2-Gen bestimmt, wie schnell oder langsam Koffein abgebaut wird. Die gesunden Eigenschaften des Kaffees bleiben bei effektiven Genen erhalten.4 Wer zu den langsamen Metabolisierern gehört, reagiert empfindlicher. Das erklärt möglicherweise, warum manche Menschen schlechter vertragen auf Koffein reagieren als andere. Ein kleines genetisches Detail – mit großer Relevanz für alltägliche Entscheidungen.
Menschen mit einer „schnellen“ Genvariante verstoffwechseln Koffein effizient und profitieren eher von den positiven Effekten des Kaffees – etwa der verbesserten Konzentration oder antioxidativen Wirkung. Bei „langsamen“ Metabolisierern hingegen überwiegen bei zu hoher Zufuhr oft die unerwünschten Nebenwirkungen.
Gemeinsam Zukunft gestalten
Werden Sie Novogenia Partner
Nutzen Sie die Innovationskraft eines führenden Biotech-Unternehmens und erweitern Sie Ihr Angebot mit modernster Gesundheits- und Diagnostiktechnologie. Novogenia bietet Ihnen genetische Analysen der nächsten Generation, damit Sie Ihren Kunden personalisierte Einblicke in ihre individuellen Bedürfnisse ermöglichen können. Gestalten Sie mit uns die Zukunft der personalisierten Gesundheit.
Nutrigenetik: Individuelle Nährstoffbedürfnisse erkennen und verstehen
Klassische Ernährungsempfehlungen – etwa der Deutschen Gesellschaft für Ernährung (DGE) – beruhen auf Durchschnittswerten, wie etwa „400 µg Folsäure pro Tag“ oder „600 I.E. Vitamin D“. Doch genetisch bedingt benötigen manche Menschen deutlich mehr oder weniger, um eine optimale Versorgung zu erreichen.
Für Berater in Sachen Ernährung, Gesundheit und Fitness bedeutet das:
- Nicht jeder Standardplan passt für jeden.
- Nicht jede Supplementierung wirkt gleich gut.
- Nicht jeder niedrige Blutwert ist durch Ernährung allein erklärbar.
Genetische Analysen, personalisierte Lösungen
Mit dem Wissen um genetische Einflussfaktoren lässt sich klären, warum manche Maßnahmen nicht greifen – und wie Empfehlungen stattdessen präzise und nachvollziehbar gestaltet werden können. So entsteht mithilfe der Nutrigenetik eine personalisierte Ernährungsstrategie, die nicht nur auf Symptomen, sondern auf Ursachenebene ansetzt.
Die Ernährungspyramide – passt nicht für jeden
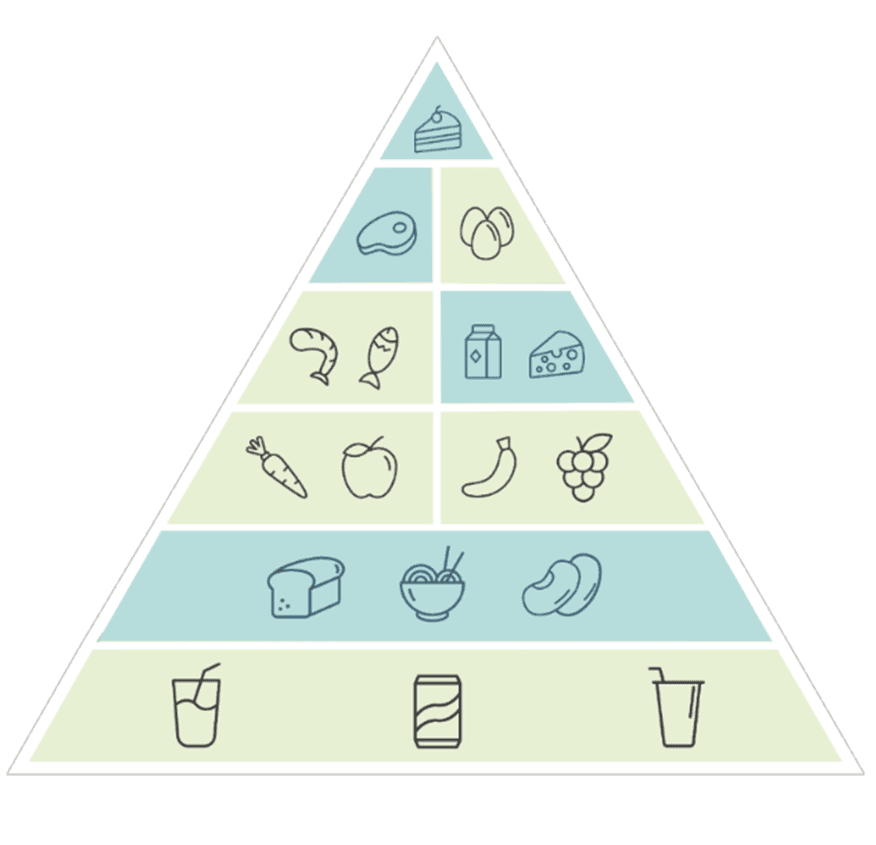
Die klassische Ernährungspyramide liefert allgemeine Orientierung für eine ausgewogene Ernährung – doch sie folgt einem „One-size-fits-all“-Ansatz, der den individuellen Unterschieden vieler Menschen nicht gerecht wird. Gerade im Licht der Nutrigenetik zeigt sich: Was für den einen gesund ist, kann für den anderen problematisch sein.
So sind etwa rund 20 % der deutschen Bevölkerung genetisch bedingt laktoseintolerant – die Empfehlung, täglich Milchprodukte zu konsumieren, ist für sie nicht sinnvoll. Ähnlich verhält es sich bei glutensensitiven Menschen, die genetisch zu einer Unverträglichkeit neigen oder sogar eine Prädisposition für Zöliakie aufweisen. Auch Gene wie HFE, die die Eisenaufnahme regulieren, zeigen: Manche Menschen speichern Eisen schneller als andere – bei ihnen kann der übermäßige Verzehr eisenreicher Lebensmittel gesundheitliche Risiken bergen.
Die Ernährungspyramide geht von einem statistischen Durchschnitt aus – doch die Nutrigenetik lädt dazu ein, Ernährung neu zu denken: differenziert, datengestützt und biologisch sinnvoll. Was wir essen sollten, hängt nicht nur von Kultur oder Empfehlungen ab – sondern auch davon, wie unser Körper mit bestimmten Nährstoffen umgehen kann.
Was Nutrigenetik und Gen-Analysen sichtbar machen können
Eine genetische Analyse ist wie ein Blick unter die Motorhaube – sie zeigt, wie der Körper „gebaut“ ist, bevor überhaupt Symptome auftreten. Anders als bei Blutwerten, die den aktuellen Zustand erfassen, zeigt die Gen-Analyse strukturelle Eigenschaften: z. B. ob bestimmte Enzyme eher langsam arbeiten, ob Transportmechanismen weniger aktiv sind oder ob ein höherer Bedarf an bestimmten Mikronährstoffen besteht.
Im Rahmen der Nutrigenetik lassen sich dabei unter anderem folgende Fragen klären:
- Makronährstoff-Typen: Eignet sich jemand besser für eine kohlenhydratreduzierte Ernährung oder benötigt er mehr Fette oder Proteine?
- Mikronährstoffe: Gibt es genetisch bedingte Schwächen in der Verwertung von Vitamin D, B12, Eisen, Omega-3 oder Folsäure?
- Entgiftung und antioxidativer Schutz: Wie leistungsfähig ist der Körper beim Umgang mit oxidativem Stress?
Diese Informationen schaffen eine neue Tiefe in der Beratung: weg von der reinen Optimierung von Symptomen – hin zu einer nutrigenetisch basierten Ernährungsstrategie.
Wie Gen- und Blutanalysen Hand in Hand arbeiten
Noch besser können genetische Informationen ausgewertet werden, wenn sie mit aktuellen Blutwerten und Lebensstilfaktoren kombiniert werden. Denn während die genetische Analyse die Anlage beschreibt, also das „Bauprinzip“ des Körpers, zeigen Blutwerte den aktuellen Zustand – also, wie es jetzt im Hier und Jetzt aussieht.
Das Zusammenspiel beider Ebenen ermöglicht einen ganzheitlichen Blick auf den Menschen und eine präzisere, differenziertere Beratung. Für Berater bedeutet das: Empfehlungen werden belastbarer, nachvollziehbarer und individueller. Für Kunden entsteht mehr Sicherheit – und das gute Gefühl, wirklich gesehen und verstanden zu werden.
Von der Analyse zur Anwendung: Das individuelle Ernährungskonzept
Die genetische Analyse ist kein Selbstzweck. Stattdessen steht die praktische Umsetzung der Ergebnisse aus der Analyse im Mittelpunkt. Aus dem Zusammenspiel von genetischen Daten, aktuellen Blutwerten und Lebensstilfaktoren entsteht ein maßgeschneiderter Ernährungsfahrplan, der verständlich, motivierend und langfristig wirksam ist.
- Klarheit für Kunden: Warum bisherige Maßnahmen nicht funktioniert haben – und was jetzt besser passen könnte.
- Konkrete Empfehlungen: Welche Lebensmittel bevorzugt, reduziert oder vermieden werden sollten – auf Basis des genetischen Profils.
- Bessere Planbarkeit: Supplementierungspläne, Einkaufslisten, Rezeptideen und ein realistischer Fahrplan für die Umsetzung.
Aus der Praxis: Nutrigenetik in Prävention und Gesundheitsförderung
Warum nehmen manche Menschen bereits bei kleinen Ernährungssünden zu, während andere scheinbar alles problemlos essen können? Ein Teil der Antwort liegt in den Genen – insbesondere bei Varianten, die die Fettverwertung oder Appetitregulation beeinflussen.
Ein Beispiel: Eine Kundin mit einer Variante im FABP2-Gen nimmt Fett aus der Nahrung besonders effizient auf. Bereits kleine Fettmengen führen bei ihr schneller zur Gewichtszunahme. In der Beratung kann nun gezielt eine fettbewusste Ernährung mit hohem Ballaststoffanteil empfohlen werden – nicht aus Prinzip, sondern aufgrund genetischer Voraussetzungen.
Ein anderer Fall: Ein Mann mit einer MC4R-Variante neigt zu Heißhungerattacken, besonders abends. Die genetische Analyse hilft hier nicht nur, das „Warum“ zu verstehen, sondern auch, gezielte Verhaltensstrategien (z. B. eiweißreiche Abendmahlzeiten) zu entwickeln, um die Appetitregulation zu stabilisieren.
Empfehlungen: Nährstoffzufuhr optimieren und Krankheiten gezielt vorbeugen
Viele chronische Erkrankungen entstehen nicht plötzlich, sondern entwickeln sich schleichend über Jahre hinweg – oft durch ein Zusammenspiel aus genetischer Veranlagung, Lebensstil und Mikronährstoffmängeln. Hier kann die Nutrigenetik wertvolle Hinweise liefern, welche individuellen Schwächen im Stoffwechsel bestehen, lange bevor Symptome auftreten.
Genetische Varianten können etwa die Aktivität bestimmter Enzyme vermindern, die für Entgiftungsprozesse, Gefäßgesundheit oder den Zellschutz zuständig sind. Solche Schwächen erhöhen das Risiko für entzündliche Prozesse, oxidativen Stress oder Störungen im Homocystein-Stoffwechsel – und damit für Erkrankungen wie Arteriosklerose, Diabetes oder neurodegenerative Veränderungen. Auch zu Unverträglichkeiten kann es kommen, z.B. gegen Laktose und Gluten. Eine personalisierte Ernährung kann helfen, genetische Besonderheiten in der Nährstoffverwertung frühzeitig zu berücksichtigen.
Leistung steigern im Sport und im Alltag
Auch im Bereich der körperlichen und geistigen Leistungsfähigkeit bietet die Nutrigenetik wertvolle Einblicke. Genetische Unterschiede können erklären, warum manche Menschen schneller ermüden, langsamer regenerieren, sich leichter verletzen oder empfindlicher auf Belastungen reagieren, ob ihr genetisches Profil eher auf Ausdauer- oder Kraftleistungen ausgelegt ist. Durch die Analyse relevanter Gene können Ernährung, Training und Supplementierung gezielt auf den persönlichen Bedarf abgestimmt werden.5 Dabei geht es nicht nur um Höchstleistung im Sport, sondern auch um mehr Energie, mentale Klarheit und Belastbarkeit im Alltag.
Das Ziel der Nutrigenetik für Beratern: Individuelle Schwächen im Energiestoffwechsel, der antioxidativen Kapazität oder der Mikronährstoffverwertung zu erkennen – und gezielt auszugleichen, bevor es zu Leistungseinbußen kommt.
Richtige Ernährungsweise für Vitalität und Prävention im Alter
Mit zunehmendem Alter verändert sich der Stoffwechsel. Regenerationsprozesse verlangsamen sich, die Nährstoffaufnahme nimmt ab, und das Risiko für altersbedingte Erkrankungen steigt. Gleichzeitig gewinnen präventive Maßnahmen an Bedeutung, um Gesundheit, Lebensqualität und Selbstständigkeit möglichst lange zu erhalten. Genetische Analysen helfen dabei, altersrelevante Risikofaktoren frühzeitig zu identifizieren, etwa eine verminderte Knochenstabilität, eingeschränkte Entgiftung oder eine reduzierte Zellschutzkapazität. Auf dieser Grundlage lassen sich Ernährung, Bewegung und Mikronährstoffzufuhr gezielt anpassen – nicht erst bei Beschwerden, sondern vorbeugend.
Nutrigenetik als Chance für präzisere Gesundheitsberatung
Die Nutrigenetik eröffnet eine neue Dimension in der Ernährungs- und Gesundheitsberatung: weg vom Gießkannenprinzip – hin zur Präzision. Sie erlaubt es, Ernährung nicht länger pauschal zu empfehlen, sondern anhand genetischer Grundlagen gezielt auf die individuellen Bedürfnisse eines Menschen einzugehen.
Ernährung neu denken – personalisiert statt pauschal
Jede Empfehlung, die auf dem genetischen Profil basiert, ist ein Schritt hin zu mehr Individualität. Genetisches Profil statt statistischer Mittelwerte: Ernährung wird zur individuellen Maßnahme – auf Basis objektiver genetischer Daten, nicht allgemeiner Richtwerte. Das bedeutet nicht, dass bewährte Grundsätze der gesunden Ernährung überholt sind. Doch sie lassen sich gezielter und wirksamer anwenden, wenn man weiß, wie der Körper tatsächlich „tickt“.
Wissenschaft als Werkzeug – nicht als Versprechen
Nutrigenetische Erkenntnisse sind kein Allheilmittel. Aber sie sind ein präzises Werkzeug, um Beratung auf Basis der DNA fundierter, differenzierter und individueller zu gestalten. Sie ersetzt weder Erfahrung noch Empathie – aber sie ergänzt beides durch eine neue, objektive Datenbasis. Damit wird aus Wissenschaft kein leeres Versprechen, sondern eine verlässliche Grundlage für sinnvolle Gesundheitsstrategien – ganz im Sinne einer modernen, verantwortungsvollen und wirksamen Beratung.
- 1 Bouchard, Claude; Ordovas, Jose M.: Fundamentals of nutrigenetics and nutrigenomics. In: Progress in Molecular Biology and Translational Science, Bd. 108 (2012), S. 1–15. DOI: 10.1016/B978-0-12-398397-8.00001-0 (zuletzt aufgerufen am: 24.03.2025).
- 2 Reilly, R., McNulty, H., Pentieva, K., Strain, J. J., & Ward, M. (2014). MTHFR 677TT genotype and disease risk: is there a modulating role for B-vitamins? Proceedings of the Nutrition Society, 73(1), 47–56. DOI: https://doi.org/10.1017/S0029665113003613 (zuletzt aufgerufen am: 24.03.2025).
Huang, W. J. (2019). Effects of folic acid on oligozoospermia with MTHFR polymorphisms in terms of seminal parameters, DNA fragmentation, and live birth rate: a double-blind, randomized, placebo-controlled trial. Andrology. doi: 10.1111/andr.12652 (zuletzt aufgerufen am: 24.03.2025). - 3 Traver, R. D., Siegel, D., Beall, H. D., Phillips, R. M., Gibson, N. W., Franklin, W. A., & Ross, D. (1997). Characterization of a polymorphism in NAD(P)H: quinone oxidoreductase (DT-diaphorase). British Journal of Cancer, 75(1), 69–75. DOI: 10.1038/bjc.1997.11.
URL: https://pubmed.ncbi.nlm.nih.gov/9000600/ (zuletzt aufgerufen am: 24.03.2025)
- 4 Cornelis, M. C., El-Sohemy, A., Kabagambe, E. K., & Campos, H. (2006). Coffee, CYP1A2 genotype, and risk of myocardial infarction. JAMA, 295(10), 1135–1141. DOI: 10.1001/jama.295.10.1135. URL: https://pubmed.ncbi.nlm.nih.gov/16522833/ (zuletzt aufgerufen am: 24.03.2025)
- 5 Appel, M., Zentgraf, K., Krüger, K., & Alack, K. (2021). Effects of Genetic Variation on Endurance Performance, Muscle Strength, and Injury Susceptibility in Sports: A Systematic Review. Frontiers in Physiology, 12, 694411. https://doi.org/10.3389/fphys.2021.694411